活動
2021年5月26日
レット症候群原因因子による神経幹細胞の分化制御メカニズムを明らかに
~発達障害の発症メカニズムの解明と新たな治療法開発に期待~
九州大学大学院医学研究院の中嶋秀行助教、中島欽一教授らの研究グループは、広島大学大学院統合生命科学研究科の今村拓也教授、名古屋大学大学院理学研究科・高等研究院の辻村啓太特任講師、慶應義塾大学医学部生理学教室の岡野栄之教授らとの共同研究により、神経発達障害レット症候群の原因因子であるmethyl-CpG binding protein 2(MeCP2)がマイクロRNA(miRNA)を介して神経幹細胞の分化を制御していることを発見し、そのメカニズムを明らかにしました。
レット症候群は自閉症、てんかん、失調性歩行、特有の常同運動(手もみ動作)を主徴とする進行性の神経発達障害です。MeCP2遺伝子の変異により発症することはわかっているもののその発症機序の詳細は不明でした。本研究グループは脳の発生過程において、MeCP2が神経幹細胞のニューロンへの分化を促進し、通常はニューロンの機能を支持するアストロサイトへの分化は抑制していることを明らかにしました。また、そのメカニズムについて調べた結果、MeCP2はmiR-199aというmiRNAを介して脳の発達に重要な骨形成因子(BMP)シグナルを抑制することで、神経幹細胞の分化を制御していることがわかりました。さらに、MeCP2遺伝子に変異をもつレット症候群患者由来のiPS細胞から作製した脳オルガノイドではBMPシグナルの亢進とアストロサイトへの分化増加がみられ、これらがBMPシグナル阻害剤により改善できることが明らかになりました。以上の結果は、レット症候群患者脳では、神経幹細胞からニューロンやアストロサイトへの分化バランスが上手く制御されていない可能性を示しており、そのバランスの正常化によるレット症候群の新しい治療法開発へとつながることが期待されます。
本研究成果は、2021年5月18日(火)午前11時(米国東部標準時間)に国際学術雑誌『Cell Reports』に掲載されました。
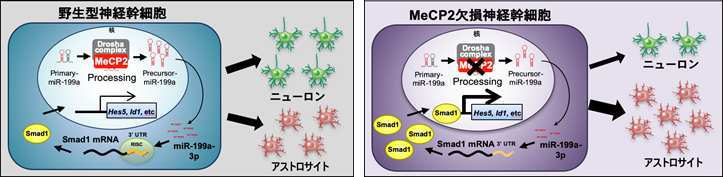
図:MeCP2は神経幹細胞の分化バランスを制御する
野生型神経幹細胞では、MeCP2とDrosha複合体がPri-miR-199aをプロセシングし、正常なレベルのMature-miR199a-3pが産生される。Mature-miR199a-3pはBMP下流転写因子Smad1を標的とすることでニューロン分化とアストロサイト分化の適度なバランスを制御する(左図)。
一方、MeCP2欠損神経幹細胞では、MeCP2欠損のためDrosha複合体がPri-miR199aを正常にプロセシングできず、Mature-miR199a-3pが十分量産生されない。その結果、Smad1タンパク質の異常増加により、ニューロン分化が抑制され、アストロサイト分化優位へとバランスがシフトする(右図)。
プレスリリースはこちら
https://www.kyushu-u.ac.jp/ja/researches/view/603
Cell Reports掲載ページはこちら
https://www.cell.com/cell-reports/fulltext/S2211-1247(21)00463-0
